I swear to what yah! the people at this school, all the arrogant style, not criticized, bossy!
verdammt noch mal! sie dachten, eine Geschichte über Freundschaft und Romantik sind sie wert zu hören! Ich denke, es ist sehr saugt und nicht sehenswert! Ich hasse jene, die meine Schule! der behauptete, er war mächtig clever! smart! alles wissen! er immer erzählt die Geschichte sucks! Ich hasse sie! Gott möge erwachen sie!
terjemahannya :Ddamn it! they thought a story about friendship and romance they are worth the listen! I think it's very sucks and not worth seeing! I hate those who are my school! who claimed he was mighty clever! smart! know everything! he always tells the story sucks! I hate them! may God awaken them!
Minggu, 25 Desember 2011
:) its sure :)
ohh dear, today I am more motivated by people's .. they have a unique life. just like me,, O god,, if I like them ..
I think so myself but it's better .. anyway I also can not be like them, seperti kata pepatah "BAGAIKAN PUNUK MERINDUKAN BULAN" hahahaha .. I was just a kid who always want to be better .. :) The most important thing I have to try and continue to pursue my dreams! spirit! god always protect me in every way my life,, aamin
I think so myself but it's better .. anyway I also can not be like them, seperti kata pepatah "BAGAIKAN PUNUK MERINDUKAN BULAN" hahahaha .. I was just a kid who always want to be better .. :) The most important thing I have to try and continue to pursue my dreams! spirit! god always protect me in every way my life,, aamin
DAn OrAng~orang yunani berkata~ :D
Phytagoras
• Phytagoras berkata,”jika engkau ingin hidup senang ,mka hendaklah engkau rela di anggap sebgai tidak berakal atau di anggap orang bodoh”.
• Pukulan dari sahabatmu lebih baik dari pada ciuman dari musuhmu.
• Phytagoras berkata,”jangan sekali-kali percaya paada kasih saying yang datang tiba-tiba,karena dia akan meninggalkanmu dengan tiba-tiba pula”.
• Jangan membanggakan apa yang kamu lakukan hari ini, sebab engkau tidaka akan tahu apa yang akan di berikan oleh hari esok.
Plato
• Orang yang ingin bergembira harus menyukai kelelahan akibat bekerja.
• Janganlah engkau berteman dengan orang jahat karena sifatmu akan mencuri sifatnya tanpa engkau sadari.
• Plato berkata ,”Orang yang berilmu mengetahi orang yang bodoh karena dia pernah bodoh,sedangkan orang yang bodoh tidak mengetahui orang yang berilmu karena dia tidak pernah berilmu”.
• Budi pekerti yang tinggi adalah rasa malu terhadap diri sendiri.
• Plato di Tanya ,”Bagaimana caranya agar seseorang biasa hidup dengan tenang?”. Dia menjawab ,” Jika orang itutidak melakukan kejahatanh dan tidak beredihh akan sesuatu yang di alaminya,maka dia tentu akan merasa tenang”.
• Kerendahan seseorang di ketahui melalui dua hal : banyak berbicara tentang hal-hal yang tidak berguna,dan bercerita padahal tidak di tanya.
• Jangan terlalu banyak mengenal orang .sebab, kalian lebih sering di sakiti oleh orang yang kalian kenal,sedangkan orang yang tidak kalian kenal nyaris tidak dapat menyakiti kalian.
• Cint6a adalah gerak jiwa yang kosong tanpa pikiran.
Thales
• “orang yang bercita-cita tinggi adalah orang yang menganggap teguran teguran keras baginya lenbut daripada sanjungan merdu dari penjilat yang berlebih-lebihan”
• “apabila kamu menasihati orang yang bersalah maka berlemah lembutlah agar dia tidak merasa di telanjangi”
• “orang yang secara sembunyi-sembunyi melakukan suatu perbuatan yang tidak di llakukan secara terang-terangan,ia tidak berharga di hadapan dirinya”
Socrates
• Seseorang menampar pipi Socrates,lalu pada bekas tamparan itu Socrates menulis “Seseorang telah menamparku ini balasan dariku”.
• Socrates di cela karena makan terlalu sedikit, maka di menjawab,“aku makan untuk hidup, bukan hidup untuk makan”.
• Socrates di cela karena di tidak banyak bicara, dia menjawab,”Allah Taala telah menciptakan dua telinga dan satu lidah untukku agar aku banyak mendengar daripada berbicara,tetapi kalian lebih banyak bicara daripada mendengar”.
• Setelah berusia tua,Socrates,belajar musik. Lalu ada orang berkata padanya,” apakah engkau tidak malu belajar di usia tua?”. Dia menjawab,” Aku merasa lebih malu menjadi orang yang bodoh di usia tua”.
• Socrates berkata,”Cobalah dulu,baru cerita. Pahamilah dulu,baru menjawab. Pikirlah dulu,baru berkata.Dengarlah dulu,baru beri penilaian .Bekerjalah dulu,baru berharap.
• Socrates berkata ,” kesedihan membuat akal terpana dan tidak berdaya.jika anda tertimpa kesedihan, terimalah dia dengan keteguhan hati dan berdayakanlah akal untuk mencari jalan keluar”.
• Janganlah engaku menceritakan isi jiwamu kepada oarng lain,karena sungguh jelek orang yang menaruh hartanya di rumah dan memerkan isinya.
• Kesejahteraaan memberikan peringatan,sedangkan bencana memberi nasihat.
• Janagn mengomentari kesalahan orang lain, karena orang itu akan mengambil manfaat dari ilmumu lalu di menjadi musuhmu.
• Phytagoras berkata,”jika engkau ingin hidup senang ,mka hendaklah engkau rela di anggap sebgai tidak berakal atau di anggap orang bodoh”.
• Pukulan dari sahabatmu lebih baik dari pada ciuman dari musuhmu.
• Phytagoras berkata,”jangan sekali-kali percaya paada kasih saying yang datang tiba-tiba,karena dia akan meninggalkanmu dengan tiba-tiba pula”.
• Jangan membanggakan apa yang kamu lakukan hari ini, sebab engkau tidaka akan tahu apa yang akan di berikan oleh hari esok.
Plato
• Orang yang ingin bergembira harus menyukai kelelahan akibat bekerja.
• Janganlah engkau berteman dengan orang jahat karena sifatmu akan mencuri sifatnya tanpa engkau sadari.
• Plato berkata ,”Orang yang berilmu mengetahi orang yang bodoh karena dia pernah bodoh,sedangkan orang yang bodoh tidak mengetahui orang yang berilmu karena dia tidak pernah berilmu”.
• Budi pekerti yang tinggi adalah rasa malu terhadap diri sendiri.
• Plato di Tanya ,”Bagaimana caranya agar seseorang biasa hidup dengan tenang?”. Dia menjawab ,” Jika orang itutidak melakukan kejahatanh dan tidak beredihh akan sesuatu yang di alaminya,maka dia tentu akan merasa tenang”.
• Kerendahan seseorang di ketahui melalui dua hal : banyak berbicara tentang hal-hal yang tidak berguna,dan bercerita padahal tidak di tanya.
• Jangan terlalu banyak mengenal orang .sebab, kalian lebih sering di sakiti oleh orang yang kalian kenal,sedangkan orang yang tidak kalian kenal nyaris tidak dapat menyakiti kalian.
• Cint6a adalah gerak jiwa yang kosong tanpa pikiran.
Thales
• “orang yang bercita-cita tinggi adalah orang yang menganggap teguran teguran keras baginya lenbut daripada sanjungan merdu dari penjilat yang berlebih-lebihan”
• “apabila kamu menasihati orang yang bersalah maka berlemah lembutlah agar dia tidak merasa di telanjangi”
• “orang yang secara sembunyi-sembunyi melakukan suatu perbuatan yang tidak di llakukan secara terang-terangan,ia tidak berharga di hadapan dirinya”
Socrates
• Seseorang menampar pipi Socrates,lalu pada bekas tamparan itu Socrates menulis “Seseorang telah menamparku ini balasan dariku”.
• Socrates di cela karena makan terlalu sedikit, maka di menjawab,“aku makan untuk hidup, bukan hidup untuk makan”.
• Socrates di cela karena di tidak banyak bicara, dia menjawab,”Allah Taala telah menciptakan dua telinga dan satu lidah untukku agar aku banyak mendengar daripada berbicara,tetapi kalian lebih banyak bicara daripada mendengar”.
• Setelah berusia tua,Socrates,belajar musik. Lalu ada orang berkata padanya,” apakah engkau tidak malu belajar di usia tua?”. Dia menjawab,” Aku merasa lebih malu menjadi orang yang bodoh di usia tua”.
• Socrates berkata,”Cobalah dulu,baru cerita. Pahamilah dulu,baru menjawab. Pikirlah dulu,baru berkata.Dengarlah dulu,baru beri penilaian .Bekerjalah dulu,baru berharap.
• Socrates berkata ,” kesedihan membuat akal terpana dan tidak berdaya.jika anda tertimpa kesedihan, terimalah dia dengan keteguhan hati dan berdayakanlah akal untuk mencari jalan keluar”.
• Janganlah engaku menceritakan isi jiwamu kepada oarng lain,karena sungguh jelek orang yang menaruh hartanya di rumah dan memerkan isinya.
• Kesejahteraaan memberikan peringatan,sedangkan bencana memberi nasihat.
• Janagn mengomentari kesalahan orang lain, karena orang itu akan mengambil manfaat dari ilmumu lalu di menjadi musuhmu.
Sabtu, 17 Desember 2011
Rabu, 07 Desember 2011
TERMOKIMIA
LENGKAP KIMIA TERMOKIMIA SMA
Termokimia dapat didefinisikan sebagai bagian ilmu kimia yang mempelajari dinamika atau perubahan reaksi kimia dengan mengamati panas/termal nya saja. Salah satu terapan ilmu ini dalam kehidupan sehari-hari ialah reaksi kimia dalam tubuh kita dimana produksi dari energi-energi yang dibutuhkan atau dikeluarkan untuk semua tugas yang kita lakukan. Pembakaran dari bahan bakar seperti minyak dan batu bara dipakai untuk pembangkit listrik. Bensin yang dibakar dalam mesin mobil akan menghasilkan kekuatan yang menyebabkan mobil berjalan. Bila kita mempunyai kompor gas berarti kita membakar gas metan (komponen utama dari gas alam) yang menghasilkan panas untuk memasak. Dan melalui urutan reaksi yang disebut metabolisme, makanan yang dimakan akan menghasilkan energi yang kita perlukan untuk tubuh agar berfungsi.
Hampir semua reaksi kimia selalu ada energi yang diambil atau dikeluarkan. Mari kita periksa terjadinya hal ini dan bagaimana kita mengetahui adanya perubahan energi.

Peristiwa termokimia
Kebanyakan reaksi kimia tidaklah tertutup dari dunia luar. Bila campuran reaksi menjadi panas seperti digambarkan dibawah, panas dapat mengalir ke sekelilingnya. Setiap perubahan yang dapat melepaskan energi ke sekelilingnya seperti ini disebut perubahan eksoterm. Perhatikan bahwa bila terjadi reaksi eksoterm, temperatur dari campuran reaksi akan naik dan energi potensial dari zat-zat kimia yang bersangkutan akan turun.
Kadang-kadang perubahan kimia terjadi dimana ada kenaikan energi potensial dari zat-zat bersangkutan. Bila hal ini terjadi, maka energi kinetiknya akan turun sehingga temperaturnya juga turun. Bila sistem tidak tertutup di sekelilingnya, panas dapat mengalir ke campuran reaksi dan perubahannya disebut perubahan endoterm. Perhatikan bahwa bila terjadi suatu reaksi endoterm, temperatur dari campuran reaksi akan turun dan energi potensial dari zat-zat yang ikut dalam reaksi akan naik.

Peristiwa kebakaran menghasilkan panas
Pengukuran Energi Dalam Reaksi Kimia
Satuan internasional standar untuk energi yaitu Joule (J) diturunkan dari energi kinetik. Satu joule = 1 kgm2/s2. Setara dengan jumlah energi yang dipunyai suatu benda dengan massa 2 kg dan kecepatan 1 m/detik (bila dalam satuan Inggris, benda dengan massa 4,4 lb dan kecepatan 197 ft/menit atau 2,2 mile/jam).1 J = 1 kg m2/s2
Satuan energi yang lebih kecil yang dipakai dalam fisika disebut erg yang harganya = 1×10-7 J. Dalam mengacu pada energi yang terlibat dalam reaksi antara pereaksi dengan ukuran molekul biasanya digantikan satuan yang lebih besar yaitu kilojoule (kJ). Satu kilojoule = 1000 joule (1 kJ = 1000J).
Semua bentuk energi dapat diubah keseluruhannya ke panas dan bila seorang ahli kimia mengukur energi, biasanya dalam bentuk kalor. Cara yang biasa digunakan untuk menyatakan panas disebut kalori (singkatan kal). Definisinya berasal dari pengaruh panas pada suhu benda. Mula-mula kalori didefinisikan sebagai jumlah panas yang diperlukan untuk menaikkan temperatur 1 gram air dengan suhu asal 150C sebesar 10C. Kilokalori (kkal) seperti juga kilojoule merupakan satuan yang lebih sesuai untuk menyatakan perubahan energi dalam reaksi kimia. Satuan kilokalori juga digunakan untuk menyatakan energi yang terdapat dalam makanan.
Dengan diterimanya SI, sekarang juga joule (atau kilojoule) lebih disukai dan kalori didefinisi ulang dalam satuan SI. Sekarang kalori dan kilokalori didefinisikan secara eksak sebagai berikut :
1 kal = 4,184 J
1 kkal = 4,184 kJ
KIMIA ORGANIK
SENYAWA HIDROKARBON
Disebut Hidrokarbon : mengandung unsur C dan H
Terdiri dari : 1. Alkana (CnH2n+2)
2. Alkena (CnH2n)
3. Alkuna (CnH2n-2)
ALKANA
q
Hidrokarbon jenuh (alkana rantai lurus dan
siklo/cincin alkana)
q
Disebut golongan parafin : affinitas kecil
(=sedikit gaya gabung)
q
Sukar bereaksi
q
C1 – C4 : pada t dan p normal adalah gas
q
C4 – C17 : pada t dan p normal adalah cair
q
> C18 : pada t dan p
normal adalah padat
q
Titik didih makin tinggi : terhadap penambahan
unsur C
q
Jumlah atom C sama : yang bercabang mempunyai TD
rendah
q
Kelarutan : mudah larut dalam pelarut non polar
q
BJ naik dengan penambahan jumlah unsur C
q
Sumber utama gas alam dan petrolium
Struktur ALKANA : CnH2n+2 CH3-CH2-CH2-CH2-CH2-CH3
(heksana)
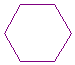 |
sikloheksana
PEMBUATAN ALKANA :
Ø
Hidrogenasi senyawa Alkena
Ø
Reduksi Alkil Halida
Ø
Reduksi metal dan asam
PENGGUNAAN ALKANA :
ä Metana
: zat bakar, sintesis, dan carbon black (tinta,cat,semir,ban)
ä Propana,
Butana, Isobutana : zat bakar LPG (Liquified Petrolium Gases)
ä Pentana,
Heksana, Heptana : sebagai pelarut pada sintesis
Fraksi tertentu dari Destilasi langsung Minyak
Bumi/mentah
|
TD
(oC)
|
Jumlah C |
Nama
|
Penggunaan
|
|
<
30
|
1
- 4
|
Fraksi gas
|
Bahab bakar gas
|
|
30
- 180
|
5
-10
|
Bensin
|
Bahan bakar mobil
|
|
180
- 230
|
11
- 12
|
Minyak tanah
|
Bahan bakar memasak
|
|
230
- 305
|
13
- 17
|
Minyak gas ringan
|
Bahan bakar diesel
|
|
305
- 405
|
18
- 25
|
Minyak gas berat
|
Bahan bakar pemanas
|
Sisa destilasi :
1.
Minyak mudah menguap, minyak pelumas, lilin dan
vaselin
2.
Bahan yang tidak mudah menguap, aspal dan kokas
dari m. bumi
ALKENA
q
Hidrokarbon tak jenuh ikatan rangkap dua
q
Alkena = olefin (pembentuk minyak)
q
Sifat fisiologis lebih aktif (sbg obat tidur) :
2-metil-2-butena
q
Sifat sama dengan Alkana, tapi lebih reaktif
STRUKTUR ALKENA : CnH2n CH3-CH2-CH=CH2
(1-butena)
ETENA = ETILENA = CH2=CH2
q
Sifat-sifat : gas tak berwarna, dapat dibakar, bau
yang khas, eksplosif dalam udara (pada konsentrasi 3 – 34 %)
q
Terdapat dalam gas batu bara biasa pada proses
“cracking”
q
Pembuatan : pengawahidratan etanaol
PENGGUNAAN ETENA :
ä Dapat
digunakan sebagai obat bius (dicampur dengan O2)
ä Untuk
memasakkan buah-buahan
ä Sintesis
zat lain (gas alam, minyak bumi, etanol)
PEMBUATAN ALKENA :
Ø
Dehidrohalogenasi alkil halida
Ø
Dehidrasi alkohol
Ø
Dehalogenasi dihalida
Ø
Reduksi alkuna
ALKUNA
q
Hidrokarbon tak jenuh mempunyai ikatan rangkap tiga
q
Sifat-sifatnya menyerupai alkena, tetapi lebih reaktif
Struktur ALKUNA : CnH2n-2 CH=CH (etuna/asetilen)
ETUNA = ASETILEN => CH=CH
q
Pembuatan : CaC2 + H2O ------à C2H2
+ Ca(OH)2
q
Sifat-sifat :
Ø Suatu
senyawaan endoterm, maka mudah meledak
Ø Suatu
gas, tak berwarna, baunya khas
q
Penggunaan etuna :
Ø
Pada pengelasan : dibakar dengan O2
memberi suhu yang tinggi (+- 3000oC), dipakai untuk mengelas besi
dan baja
Ø
Untuk penerangan
Ø
Untuk sintesis senyawa lain
PEMBUATAN ALKUNA
Ø
Dehidrohalogenasi alkil halida
Ø
Reaksi metal asetilida dengan alkil halida primer
SENYAWA
AROMATIK
q
Senyawa alifatis : turunan metana
q
Senyawa aromatis : turunan benzen (simbol Ar =
aril)
q
Permulaan abad ke-19 ditemukan senyawa-senyawa
organik yang mempunyai bau (aroma) yang karakteristik yang berasal dari tumbuh-tumbuhan
(damar benzoin, cumarin, asam sinamat dll)
BENZEN =C6H6
q
Senyawa aromatis yang paling sederhana
q
Berasal dari batu bara dan minyak bumi
q
Sifat fisika : cairan, td. 80oC, tak berwarna, tak
larut dalam air, larut dalam kebanyakan pelarut organik, mudah terbakar dengan
nyala yang berjelaga dan berwarna (karena kadar C tinggi)
Pengunaan Benzen :
Ø
Dahulu sebagai bahan bakar motor
Ø
Pelarut untuk banyak zat
Ø
Sintesis : stirena, fenol, nilon, anilin, isopropil
benzen, detergen, insektisida, anhidrida asam maleat, dsb
ALKIL
HALIDA
q
Senyawa alkil halida merupakan senyawa hidrokarbon
baik jenuh maupun tak jenuh yang satu unsur H-nya atau lebih digantikan oleh
unsur halogen (X = Br, Cl. I)
q
Alkil halida = haloalkana = RX struktur primer, sekunder, tersier
q
Aril halida = ArX = senyawa halogen organik
aromatik
Sifat fisika Alkil Halida :
¨
Mempunyai TD lebih tinggi dari pada TD Alkana
dengan jumlah unsur C yang sama.
¨
Tidak larut dalam air, tapi larut dalam pelarut
organik tertentu.
¨
Senyawa-senyawa bromo, iodo dan polikloro lebih
berat dari pada air.
Struktur Alkil Halida :
R-X (X=Br, Cl, I)
CH3-CH2-CH2-CH2-Cl (CH3)2CH-Br (CH3)3C-Br
Primer sekunder tersier
 |
Benzil
khlorida Vinil
khlorida
PEMBUATAN ALKIL HALIDA :
Ø
Dari alkohol
Ø
Halogenasi
Ø
Adisi hidrogen halida dari alkena
Ø
Adisi halogen dari alkena dan alkuna
PENGGUNAAN ALKIL HALIDA :
ä Kloroform
(CHCl3) : pelarut untuk lemak, obat bius (dibubuhi etanol, disimpan
dalam botol coklat, diisi sampai penuh).
ä Tetraklorometana
= karbontetraklorida (CCl4) : pelarut untuk lemak, alat pemadam
kebakaran (Pyrene, TD rendah 77oC, uapnya berat.
ä Freon
(Freon 12 = CCl2F2, Freon 22 = CHCl2F) :
pendingin lemari es, alat “air conditioner”, sebagai propellant (penyebar)
kosmetik, insektisida, dsb.
ALKOHOL
q
Alkohol : tersusun dari unsur C, H, dan O
q
Struktur alkohol : R-OH primer, sekunder dan
tersier
Sifat fisika alkohol :
·
TD alkohol > TD alkena dengan jumlah unsur C
yang sama (etanol = 78oC,
etena = -88,6oC)
·
Umumnya membentuk ikatan hidrogen
R R
·
Berat jenis alkohol > BJ alkena
·
Alkohol rantai pendek (metanol, etanol) larut dalam
air (=polar)
Struktur Alkohol : R - OH
R-CH2-OH (R)2CH-OH (R)3C-OH
Primer sekunder tersier
PEMBUATAN ALKOHOL :
Ø
Oksi mercurasi – demercurasi
Ø
Hidroborasi – oksidasi
Ø
Sintesis Grignard
Ø
Hidrolisis alkil halida
PENGGUNAAN ALKOHOL :
ä Metanol
: pelarut, antifreeze radiator mobil, sintesis
formaldehid,metilamina,metilklorida,metilsalisilat, dll
ä Etanol
: minuman beralkohol, larutan 70 % sebagai antiseptik, sebagai pengawet, dan
sintesis eter, koloroform, dll
FENOL
q
Fenol : mengandung gugus benzen dan hidroksi
q

 Mempunyai
sifat asam
Mempunyai
sifat asam
 Mempunyai
sifat asam
Mempunyai
sifat asam
q
 Mudah
dioksidasi struktur OH
Mudah
dioksidasi struktur OH
q
Mempunyai sifat antiseptik
q
Penggunaan sbg antiseptikum dan sintesis
ETER
q
Eter : isomer atau turunan dari alkohol (unsur H
pada OH diganti oleh alkil atau aril)
q
Eter : mengandung unsur C, H, dan O
Sifat fisika eter :
·
Senyawa eter rantai C pendek berupa cair pada suhu
kamar dan TD nya naik dengan penambahan unsur C.
·
Eter rantai C pendek medah larut dalam air, eter
dengan rantai panjang sulit larut dalam air dan larut dalam pelarut organik.
·
Mudah terbakar
·
Unsur C yang sama TD eter > TD alkana dan <
TD alkohol (metil, n-pentil eter 100oC, n-heptana 98oC,
heksil alkohol 157oC).
Struktur eter : R – O – R CH3-CH2-O-CH2-CH3 (dietil eter)
CH3-CH2-O-C6H5 (fenil etil eter)
PEMBUATAN ETER :
Ø
Sintesis Williamson
Ø
Alkoksi mercurasi – demercurasi
PENGGUNAAN ETER :
ä
Dietil eter : sbg obat bius umum, pelarut dari
minyak, dsb.
ä
Eter-eter tak jenuh : pada opersi singkat : ilmu
kedokteran gigi dan ilmu kebidanan.
AMINA
q
Senyawa organik bersifat basa lemah, dibanding air
lebih basa.
q
Jumlah unsur C kecil sangat mudah larut dalam air.
Sifat fisika Amina :
·
Suku-suku rendah berbentuk gas.
·
Tak berwarna, berbau amoniak, berbau ikan.
·
Mudah larut dalam air
·
Amina yang lebih tinggi berbentuk cair/padat.
·
Kelarutan dalam air berkurang dengan naiknya BM.
Struktur amina : R-NH2, (R)2NH, (R)3N =primer,
sekunder, tersier
CH3-CH2-CH2-CH2-NH2 (CH3)2NH (CH3)3N
Primer sekunder tersier
Struktur Amina berdasarkan rantai gugus alkil/aril
:
·
Amina aromatis
·
Amina alifatis
·
Amina siklis
·
Amina campuran
PEMBUATAN AMINA :
Ø
Reduksi senyawa nitro
Ø
Reaksi alkil halida dengan amonia dan amina
PENGGUNAAN AMINA :
ä
Sebagai katalisator
ä
Dimetil amina : pelarut, absorben gas alam,
pencepat vulkanisasi, membuat sabun, dll.
ä
Trimetil amina : suatu penarik serangga.
ALDEHID
q
Aldehid adalah suatu senyawa yang mengandung gugus
karbonil (C=O) yang terikat pada sebuah atau dua buah unsur hidrogen.
q
Aldehid berasal dari “ alkohol dehidrogenatum “ (cara sintesisnya).
q
Sifat-sifat kimia aldehid dan keton umumnya serupa,
hanya berbeda dalam derajatnya. Unsur C kecil larut dalam air (berkurang + C).
q
Merupakan senyawa polar, TD aldehid > senyawa
non polar
q
Sifat fisika formaldehid : suatu gas yang baunya
sangat merangsang
q
Akrolein = propanal = CH2=CH-CHO :
cairan, baunya tajam, sangat reaktif.
FORMALDEHID = METANAL = H-CHO
¨
Sifat-sifat : satu-satunya aldehid yang berbentuk
gas pada suhu kamar, tak berwarna, baunya tajam, larutanya dalam H2O
dari 40 % disebut formalin.
¨
Penggunaan : sebagai desinfektans, mengeraskan
protein (mengawetkan contoh-contoh biologik), membuat damar buatan.
Struktur Aldehid : R – CHO
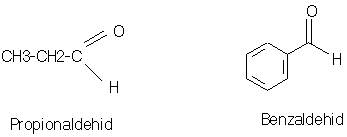
PEMBUATAN ALDEHID :
Ø
Oksidasi dari alkohol primer
Ø
Oksidasi dari metilbenzen
Ø
Reduksi dari asam klorida
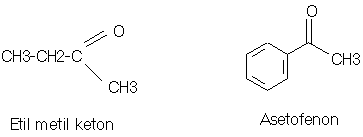
KETON
q
Keton adalah suatu senyawa organik yang mempunyai
sebuah gugus karbonil (C=O) terikat pada dua gugus alkil, dua gugus aril atau
sebuah alkil dan sebuah aril.
q
Sifat-sifat sama dengan aldehid.
PROPANON = DIMETIL KETON = ASETON = (CH3)2-C=O
¨
Sifat : cairan tak berwarna, mudah menguap, pelarut
yang baik.
¨
Penggunaan : sebagai pelarut
ASETOFENON = METIL FENIL KETON
¨
Sifat : berhablur, tak berwarna
¨
Penggunaan : sebagai hipnotik, sebagai fenasil
klorida (kloroasetofenon) dipakai sebagai gas air mata
Struktur : (R)2-C=O
PEMBUATAN KETON
Ø
Oksidasi dari alkohol sekunder
Ø
Asilasi Friedel-Craft
Ø
Reaksi asam klorida dengan organologam
ASAM
KARBOKSILAT
q
Mengandung gugus COOH yang terikat pada gugus alkil
(R-COOH) maupun gugus aril (Ar-COOH)
q
Kelarutan sama dengan alkohol
q
Asam dengan jumlah C 1 – 4 : larut dalam air
q
Asam dengan jumlah C = 5 : sukar larut dalam air
q
Asam dengan jumlah C > 6 : tidak larut dalam air
q
Larut dalam pelarut organik seperti eter, alkohol,
dan benzen
q
TD asam karboksilat > TD alkohol dengan jumlah C
sama.
Struktur
Asam Karboksilat : R – COOH dan Ar – COOH
 |
Valelat
CH3-COOH (asam asetat) Asam benzoat
ASAM FORMAT = HCOOH
¨
Sifat fisika : cairan, tak berwarna, merusak kulit,
berbau tajam, larut dalam H2O dengan sempurna.
¨
Penggunaan : untuk koagulasi lateks, penyamakkan
kulit, industri tekstil, dan fungisida.
ASAM ASETAT = CH3-COOH
¨
Sifat : cair, TL 17oC, TD 118oC,
larut dalam H2O dengan sempurna
¨
Penggunaan : sintesis anhidrat asam asetat, ester,
garam, zat warna, zat wangi, bahan farmasi, plastik, serat buatan, selulosa dan
sebagai penambah makanan.
PEMBUATAN ASAM KARBOKSILAT
Ø
Oksidasi alkohol primer
Ø
Oksidasi alkil benzen
Ø
Carbonasi Reagen Grignard
Ø
Hidrolisin nitril
AMIDA
q
Amida adalah turunan asam karboksilat, dimana gugus
–OH digan-ti dengan –NH2 atau amoniak, dimana 1 H diganti dengan
asil.
q
Sifat fisika : zat padat kecuali formamida yang
berbentuk cair, tak berwarna, suku-suku yang rendah larut dalam air, bereaksi
kira-kira netral.
Struktur Amida : R – CONH2
PEMBUATAN AMIDA :
Ø
Reaksi asam karboksilat dengan amoniak
Ø
Garam amoniumamida dipanaskan
Ø
Reaksi anhidrid asam dengan amponiak
PENGGUNAAN AMIDA :
ä
Formamida berbentuk cair, sebagai pelarut.
ä
Untuk identifikasi asam yang berbentuk cair.
ä
Untuk sintesis nilon, ds.
ESTER
q
Ester adalah turunan asam karboksilat, dimana gugus
H pada –OH diganti dengan gugus R.
q
Sifat fisika : berbentuk cair atau padat, tak
berwarna, sedikit larut dalm H2O, kebanyakan mempunyai bau yang khas
dan banyak terdapat di alam.
Struktut ester : R – COOR
PEMBUATAN ESTER :
Ø
Reaksi alkohol dan asam karboksilat
Ø
Reaksi asam klorida atau anhidrida
PENGGUNAAN ESTER :
ä
Sebagai pelarut, butil asetat (pelarut dalam
industri cat).
ä
Sebagai zat wangi dan sari wangi.
Langganan:
Postingan (Atom)